La cura delle uova, larve e giovanili

La cura delle uova
Il fine ultimo di molti allevatori di Anfibi Caudati è quello di riprodurre i propri animali. Per ottenere questo risultato è ovviamente necessario assicurarsi almeno una coppia, garantire i giusti parametri di allevamento e spesso impostare una corretta bruma/ibernazione. A questo punto se tutto è andato per il meglio, controllando il terracquario, si potranno iniziare a rinvenire le prime uova. A seconda della specie queste potranno essere deposte nei luoghi più disparati: su tronchi, sassi, vetro, substrato, piante acquatiche (qui potranno anche essere impacchettate nelle foglie), persino in luoghi molto umidi ma al di sopra della superficie dell’acqua.
Luoghi comuni per la deposizione delle uova


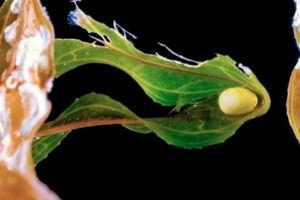
Volendo, per facilitare la deposizione o comunque incrementarne la superficie, potremo anche inserire “dispositivi” accessori, come striscette di plastica, spugne, ecc. Attenzione però, talvolta questi materiali sono mescolati ad alcune molecole potenzialmente teratogene o fatali per uova e stadi larvali, talvolta addirittura per gli adulti. Le uova riflettono abbastanza bene la luce artificiale pertanto, per individuarle meglio, basterà aiutarsi con una normalissima torcia elettrica. Alcune specie come Pachytriton sp. mostrano un minimo di cure parentali, con gli adulti che sorvegliano le uova fino alla schiusa ma, in linea di massima, una volta rinvenute si consiglia di spostarle in vasche a parte, onde evitare la predazione degli adulti o, se presenti, di altri animali che condividono la vasca come i gasteropodi acquatici. Gli episodi di oofagia da parte dei parentali variano di frequenza a seconda della specie e si va da episodi del tutto eccezionali ad altri invece decisamente ricorrenti. Le uova sono estremamente delicate quindi andranno maneggiate con estrema cura, pena la loro distruzione. Danni invisibili possono manifestarsi in seguito con l’ammuffimento delle stesse o la prematura uscita della larva, ancora in fase embrionale.
Generalmente per il prelievo si può utilizzare una siringa, priva di ago, con cui viene eseguita una leggerissima suzione sulla superficie dell’uovo. Tirando delicatamente si stacca dal substrato e si ripone delicatamente nella nuova vasca. Questo almeno per quanto riguarda uova di dimensioni medio-piccole. Alcune specie però depongono uova decisamente voluminose che finirebbero inevitabilmente per danneggiarsi all’atto della suzione. In questo caso è pertanto preferibile aiutarsi con un dispositivo diverso (lametta, stecco, spatolina, ecc.) con cui andremo delicatamente a staccarlo dal substrato e lo recupereremo con un retino. Naturalmente però ci sono le eccezioni: Urodeli asiatici della famiglia Hynobiidae, depongono veri e propri sacchi ovigeri. In questo caso le uova saranno più facilmente trasferibili, semplicemente spostano l’intero clutch.
A questo punto quello che si deve fare è controllare periodicamente le uova, rimuovendo velocemente quelle che via via ammuffiscono per evitare che le ife si propaghino anche alle sane. Generalmente le uova “buone”, quelle feconde, hanno in un primissimo tempo una colorazione metà bianca e metà nera.
Per aumentare l’ossigenazione dell’acqua è consigliato (ma non strettamente necessario) mettere un piccolo aeratore o una pompa regolata al minimo, soprattutto con specie reofile, e/o qualche pianta acquatica. L’acqua andrà cambiata parzialmente ogni giorno, con cambi di circa il 10-20%.
Nell’arco di poco tempo potremo già iniziare a vedere l’embrione in via di sviluppo, in tutte le sue caratteristiche fasi. Naturalmente in principio dovremmo aiutarci con una lente o uno stereomicroscopio, ma dopo circa 2-4 giorni già inizieremo a notare la linea primitiva e conseguentemente il solco primitivo. Poco dopo l’embrione inizierà a svilupparsi in lunghezza assumendo la forma di un fagiolo e poi di una “banana”, fino a far comparire gli abbozzi branchiali, i bilancieri e gli occhi. La larvetta in formazione inizierà a muoversi con sempre maggior frequenza e intensità, spesso con scatti improvvisi e repentini cambi di posizione.
Il consiglio a questo punto, è di iniziare a porre nella vasca con le uova alcune dafnie. Queste infatti fungeranno da “filtro biologico” e inizieranno a riprodursi, il che sarà cosa gradita in previsione della schiusa delle uova e dell’inizio della predazione delle larvette.
Se tutto va bene nell’arco di 10-28 giorni, le prime larve inizieranno a uscire dalle uova. La tempistica varia notevolmente a seconda di vari fattori: specie, pO2, t°, ecc. Ad esempio, temperature basse avranno come conseguenza un aumentato tempo di sviluppo, mentre a temperature maggiori i tempi diminuiranno sensibilmente. Attenzione però, alcune specie soprattutto di microclimi più freddi (alta montagna o elevata latitudine), non riusciranno a completare lo sviluppo con temperature eccessive, per esempio qualora l’acqua raggiungesse (e superasse) i 19°C circa. In altre specie, temperature elevate riducono i tempi di sviluppo e schiusa, ma aumentano la mortalità delle larve.
Ci sono poi specie come Ambystoma opacum che depongono le uova a terra. Queste verranno custodite accuratamente dalla femmina fino al momento della schiusa.
Casi particolari...



La cura delle larve
E finalmente ci siamo. Le prime larve sono fuori. In una primissima fase sosteranno quasi sempre immobili e adagiate su un fianco ma è perfettamente normale. Nei primi 2-3 giorni di vita infatti non si nutriranno, il loro sostegno è interamente a carico del loro sacco vitellino. Lo si riconosce facilmente poiché, già durante lo sviluppo, appare come un organo color bianco/giallo lungo tutto il ventre. In questo periodo la cosa migliore da fare è osservare e basta. È sconsigliato stimolare le larvette per farle muovere, in quanto provoca un inutile dispendio energetico e un carico di stress. Ciò che andrebbe fatto invece è continuare a cambiare l’acqua ogni giorno per non più del 10-20% del totale.
Le larve di specie torrentizie avranno una morfologia sensibilmente diversa rispetto a quelle di acque stagnanti, con corpo più compresso dorsoventralmente unito ad un maggiore sviluppo delle membrane e della muscolatura caudale (per contrastare la corrente), branchie meno sviluppate (nei ruscelli e torrenti l’ossigeno disciolto è maggiore) e, in alcune specie, bilancieri più sviluppati o zampe anteriori già alla nascita.
Esempi di larve con forme diverse come adattamento al loro habitat...



NB: evitare cambi d’acqua più consistenti. La schiusa dell’uovo comporta sempre un cambio di ambiente per il nascituro. Dal trovarsi in un ambiente relativamente protetto, la larva viene improvvisamente a trovarsi in condizioni diverse. L’ambiente che le abbiamo fornito avrà determinate caratteristiche chimico-fisiche che devono essere mantenute il più costanti possibili. Sbalzi di t°, pH, NO3-, NO2-, ecc. possono determinare uno stress potenzialmente fatale. La letalità è inversamente proporzionale allo stadio di sviluppo della larva.
Passate le prime 36-72h, le larve si trasformeranno repentinamente in predatori insaziabili. Nonostante il loro aspetto indifeso e microscopico inizieranno infatti a divorare in grandi quantità tutto quello che riusciranno a ingoiare. Stiamo dunque parlando di animali strettamente carnivori, anche se talvolta si sente parlare di allevatori che tentano di alimentare larve di Urodelo con cibi in parte vegetali, ma in linea di massima è sconsigliato! Piccola nota dolente… per le prime settimane di vita i piccoli si nutriranno esclusivamente di prede vive. È assolutamente inutile tentare di somministrare alimenti congelati o in gel. Quindi con cosa nutrirle? L’alimento migliore all’inizio sono i microcrostacei acquatici. Primi in assoluto Daphnia sp. e Artemia sp.
NB: Personalmente consiglio le dafnie, dato che sono animali d’acqua dolce e, se lasciate nella vasca, continueranno a sopravvivere e a riprodursi. Nel paragrafo precedente avevo proprio consigliato di metterne un inoculo già durante il periodo di sviluppo embriologico. Le artemie sono altrettanto valide, per carità. In più sono spesso più facilmente reperibili. Il loro unico vero problema è che sono animali d’acqua salata e quindi sopravviveranno poco se lasciati nella vasca delle larve. Uno dei problemi principali con le larve di Urodelo è che spesso sostano sul substrato in attesa che una preda passi davanti alla loro testa, non sono cacciatori “attivi”, ecco perché è meglio, secondo me, utilizzare le dafnie. Le artemie infatti sono ottime per gli avannotti dei pesci, proprio perché sono nuotatori provetti e potranno inseguirli fino all’ultimo individuo.
Alcuni ospiti indesiderati...


Attenzione anche a quali microcrostacei andremo a somministrare: animali come Ostracodi e Copepodi, hanno dimensioni analoghe a quelle di una dafnia e potrebbero essere utilizzati tranquillamente. Il loro enorme problema è che possono trasformarsi da prede in predatori, attaccando le larve e uccidendole, soprattutto nei primissimi stadi vitali. Con le larve più cresciute potranno essere utilizzati, ma sempre con parsimonia.
Dunque, ricapitolando, nelle prime 2-3 settimane, dovremo quotidianamente:
- Controllare lo stato di salute delle larve
- Effettuare cambi d’acqua di non oltre il 20%
- Immettere nuovo cibo, rigorosamente vivo
Eliminare eventuali impurità come escrementi, accumuli di esuvie dei microcrostacei, ecc (aiutarsi con una siringa)
Già in questo breve periodo di tempo, le larve quasi raddoppieranno di dimensioni e svilupperanno gli arti anteriori. A questo punto si potrà integrare il cibo anche con enchitrei o anguillole dell’aceto. In seguito, quando avranno pienamente sviluppato anche gli arti inferiori si potrà iniziare finalmente a somministrare cibo inerte.
Un’iniziale indifferenza verso questo nuovo cibo può essere del tutto normale. Questo perché le larvette dovranno abituarsi a nutrirsi seguendo l’olfatto e non più soltanto la vista. Per agevolare il processo è consigliato pertanto di utilizzare un misto di cibo vivo e inerte. In pratica: se utilizzeremo chironomus, per i primi tempi daremo un mix di individui vivi e scongelati. In questo modo si abitueranno prima al congelato, risparmiandoci quotidianamente la massiccia rimozione di cibo non consumato e lasciato a marcire.
Se infatti il cibo inerte aiuterà con la sua più immediata reperibilità richiederà, dall’altro lato, intensificare le misure di pulizia della vasca di accrescimento. Lasciare il cibo non consumato, concorrerà al rischio di insorgenza di patologie, neanche a dirlo, potenzialmente fatali.
NB: sciacquare accuratamente qualsiasi alimento congelato o in gel prima di somministrarlo. I metodi di conservazione non sono sempre efficientissimi, rischiando di provocare un accumulo di metaboliti tossici e/o sostanze dannose. Sciacquandoli accuratamente la loro carica diminuirà vertiginosamente, consentendoci di utilizzare il cibo scelto con maggiore sicurezza. Nell’eventuale dubbio sulla qualità dello stesso, non utilizzarlo!
A questo punto si potranno anche a effettuare cambi d’acqua più corposi: 1-3 volte a settimana, potremo spingerci anche al 50% ed oltre del totale.
Col progredire dell’età della larva inoltre dovremo integrare ulteriormente l’alimentazione. Spostarsi quindi decisamente verso prede più grandi, come artemie adulte, chironomus, larve di zanzara, enchitrei, pezzi di lombrico (o lombrichi XS), asellidi, gammaridi. Le dafnie via via diventeranno superflue, anche perché ne servirebbero decisamente troppe per alimentare le larve ormai grandicelle.
Contemporaneamente all’aumento di dimensioni si noteranno cambiamenti sempre più rilevanti: le zampe inizieranno ad irrobustirsi e la colorazione inizierà a modificarsi sempre più. Non solo, gli esemplari inizieranno a fare anche le prime mute! Fino a questa fase infatti le larve non hanno avuto problemi, data la costanza dell’ambiente acquatico. Ma con l’avvicinarsi all’epilogo del processo della metamorfosi, la cute acquista una concentrazione più o meno marcata di cheratinociti, per poter abituarsi al meglio all’ambiente aereo. Arrivati a questo punto si inizierà a pensare ad una modificazione del setup in previsione della successiva fase di compimento della metamorfosi. Se non era stato precedentemente utilizzato, è il momento di apporre sulla vasca un coperchio a prova di fuga.
Successivamente sarà bene abbassare il livello della colonna d’acqua a circa 2cm e predisporre numerose zone emerse. Andranno benissimo pertanto pietre, pezzi di sughero, legni, piante galleggianti. Le larve a questo punto inizieranno a riassorbire branchie e membrane caudali, grazie a cui avranno un uptake energetico ulteriore, oltre al cibo. Pertanto in questa fase gli animali potrebbero essere parzialmente o totalmente inappetenti, il tutto comunque è normale e fisiologico.
Quindi in quest’ultima fase l’attenzione dovrà focalizzarsi su:
- Mutamenti dell’organismo: riassorbimento branchie e membrane, irrobustimento degli arti, mute.
- Predisporre un coperchio a prova di fuga ma che garantisca sempre e comunque una buona aerazione.
- Abbassare il livello della colonna d’acqua.
- Porre numerosi dispositivi per la zona emersa.

I giovanili
È fatta, siamo finalmente riusciti ad avere una versione in miniatura degli adulti: un (o più) giovanile.
Il problema che dovremo affrontare da questo momento in poi è legato al microhabitat. Mentre le larve sono (ovviamente) al 100% acquatiche, a seconda della specie da noi riprodotta, potremo avere specie totalmente acquatiche, terricole o parzialmente acquatiche/terricole.
Per i giovanili totalmente acquatici valgono le stesse regole utilizzate per le larve in fase di metamorfosi tardiva. Il livello dell’acqua potrà essere alzato sensibilmente, pur mantenendo una quantità sufficiente di zone emerse. Inizialmente somministreremo cibo a giorni alterni, avendo cura di diversificare il più possibile tra lombrichi, artemia, chironomus, gammaridi, asellidi, gamberetti, pezzetti di petto di pollo. Alcuni suggeriscono anche carne macinata, ma personalmente non l’ho mai usata. L’igiene dovrà essere curata soprattutto con cambi d’acqua parziali, sifonatura del substrato e controllo dei valori chimici dell’acqua.
Per i terricoli, invece dovremo predisporre un ulteriore contenitore, di dimensioni appropriate a seconda della specie e del numero di esemplari. Non importa avere faunabox o terrari di dimensioni spropositate, anzi potrebbero influire negativamente sul controllo della salute dei piccoli che si troverebbero dispersi in un’area troppo vasta e di più difficile gestione. Questo dovrà essere riempito di un quantitativo sufficiente di torba, fibra di cocco, terriccio anche miscelati tra loro o, in alternativa, si potrà utilizzare un semplice tappeto di scottex umido o della spugna.
Andranno poi predisposti numerosi nascondigli come tronchi, sugheri, rocce, cortecce e chi più ne ha più ne metta. Se il nuovo terrarietto è provvisto di una fonte luminosa si potrà anche immettere qualche pianta. Come alimentazione andremo a somministrare collemboli, lombrichi di dimensioni adeguate, enchitrei, micro/mini grilli, camole, tonchi dei fagioli, drosofile, afidi ed onischi. Questi ultimi sono ottimi sia come cibo che come “spazzini”, rimuovendo detriti ed acari. Da evitare ragni e formiche. Per evitare di ritrovarsi senza cibo, dovremmo armarci di qualche contenitore extra dove allevare anche solo temporaneamente il cibo. Il terrario dovrebbe essere sufficientemente umido ma mai fradicio, quindi sono raccomandate 1-3 nebulizzazioni al giorno. In ogni caso controlleremo quotidianamente. Date le dimensioni dei giovanili infatti, la disidratazione avviene molto più velocemente che per un animale adulto, con conseguente aumento di pericolo di morte.
I rifugi serviranno pertanto anche da nicchie di mantenimento dell’umidità. Quotidianamente andremo anche a controllare lo stato igienico del substrato, rimuovendo feci, eventuali scarti di cibo e facendo ben attenzione alla presenza di acari. Generalmente qualcuno è sempre presente, ma se aumentano di densità potrebbero persino arrivare a predare i giovanili. Il cambio di substrato andrà effettuato periodicamente, in funzione di temperatura, numero di esemplari ospitati e tipo dello stesso. In linea di massima andrà sostituito ogni 2-12 mesi.
Per i semiacquatici/semiterricoli, semplicemente utilizzeremo una vasca sufficientemente ampia da predisporre un allestimento che includa entrambe le tipologie di cui sopra.
Sull' Autore...

Andrea Aiello, nato nel 1988 a Firenze, matura da subito un profondo interesse e fascino verso la natura e le materie scientifico-mediche. Nel 2012 consegue la laurea in Scienze Biologiche presso l’Università di Firenze. Attualmente è laureando in Medicina e Chirurgia, sempre presso la medesima Università.
Dal 2013 al 2018 è membro della Fondazione Paolo Malenotti.
Alleva con continuità Anfibi Caudati dal 2008, interessandosi soprattutto a specie medio-orientali (soprattutto del genus Neurergus) e della famiglia Plethodontidae.
E’ inoltre appassionato di Orchidee e Piante Carnivore, di cui possiede una modesta collezione, iniziata nel 2005. Tra le altre passioni figurano Fotografia, Pesca, Herping, Trekking ed Escursionismo più in generale.
“Una volta stabilizzatomi a livello lavorativo, mi piacerebbe dedicare parte della nuova abitazione all’allevamento di altre specie di Urodeli e alla coltivazione di Piante tropicali all’interno di serre. A quel punto sarei felicissimo di poter iniziare ad allevare anche alcuni rappresentanti di Anfibi Anuri.”